Forschung
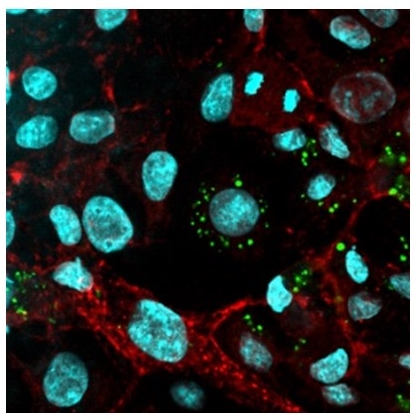
Zytokine (z.B. Interleukin-6, IL-6) sind Botenstoffe, die als Antwort auf Infektionen oder Verletzungen im Körper ausgeschüttet werden und das Immunsystem regulieren. Sie beeinflussen die Differenzierung und die Aktivierung von Immunzellen und koordinieren Entzündungsreaktionen. Auf diese Weise tragen Zytokine dazu bei, die Homöostase (das Gleichgewicht) des Organismus wiederherzustellen. Sowohl eine Hyperaktivität pro-inflammatorischer Zytokine, als auch eine verminderte Aktivität anti-inflammatorischer Zytokine, führen zu schweren Erkrankungen (z.B. Allergien, Rheuma, Krebs oder Autoimmunkrankheiten). IL-6 ist ein zentraler Induktor der Akut-Phase-Protein Expression in der Leber, reguliert die Differenzierung von B- und T-Zellen, beeinflusst aber auch die Funktion von Blutgefäßen. Des Weiteren dient es als Überlebens- und Differenzierungssignal für neuronale Zellen.
Zytokine binden an membranständige Rezeptoren und aktivieren intrazelluläre Signalkaskaden an deren Ende die Aktivierung von Transkriptionsfaktoren steht. Aktivierte Transkriptionsfaktoren binden im Zellkern an spezifische DNS Segmente und induzieren die Expression von Zielgenen. Die sequenzielle Aktivierung von Signalmolekülen in Signalkaskaden ermöglicht eine schnelle Signalverstärkung, eine komplexe Regulation, sowie die Integration von Signaleingängen, die durch verschiedene lösliche Botenstoffe oder zellulären Stress ausgelöst werden. Die Kommunikation zwischen den Zellen eines Körpers wird durch etliche Faktoren beeinflusst. Dazu gehören die lokale Konzentration der Botenstoffe, die Verfügbarkeit löslicher Rezeptoren und die zelluläre Heterogenität.
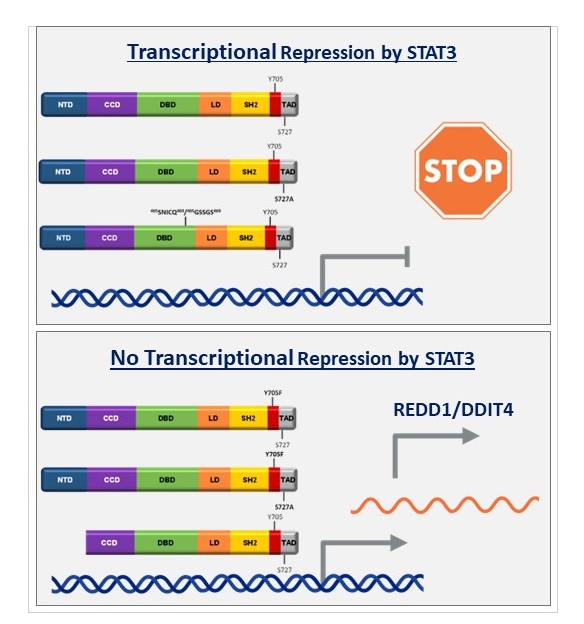
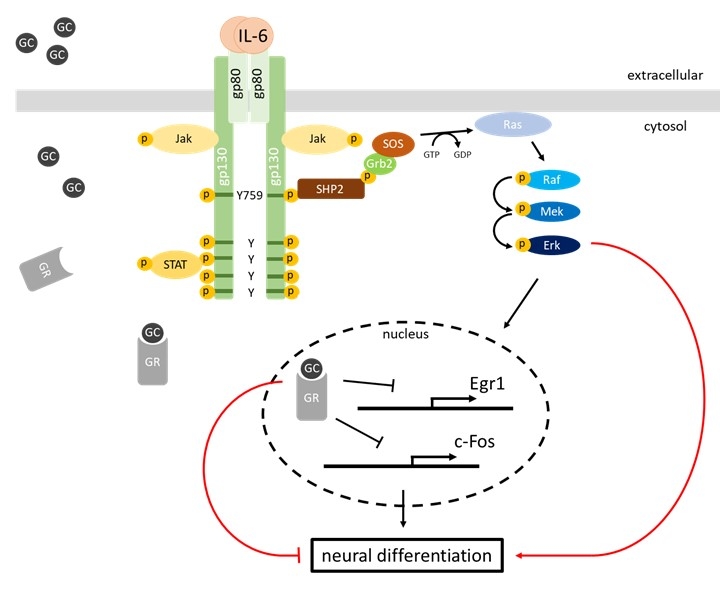
Die Stimulation der IL-6-induzierten Signaltransduktion erfolgt über einen Rezeptorkomplex aus dem IL‑6 Rezeptor α (IL-6Rα) und gp130. Nach Bindung von IL‑6 an den Rezeptorkomplex werden mit gp130 assoziierte Tyrosinkinasen (JAK1, JAK2 und TYK2) aktiviert. Daraufhin phosphorylieren diese Kinasen Tyrosylreste im zytoplasmatischen Abschnitt von gp130. Die phosphorylierten Tyrosylreste dienen als Bindemotive für Moleküle, die zur Aktivierung der MAPK (mitogen activated protein kinase) Kaskade, sowie des PI3K (Phosphoinositid-3-Kinase) /mTOR (mammalian target of rapamycin) und des JAK/STAT (signal transducer and activator of signal transduction) Signalweges führen.
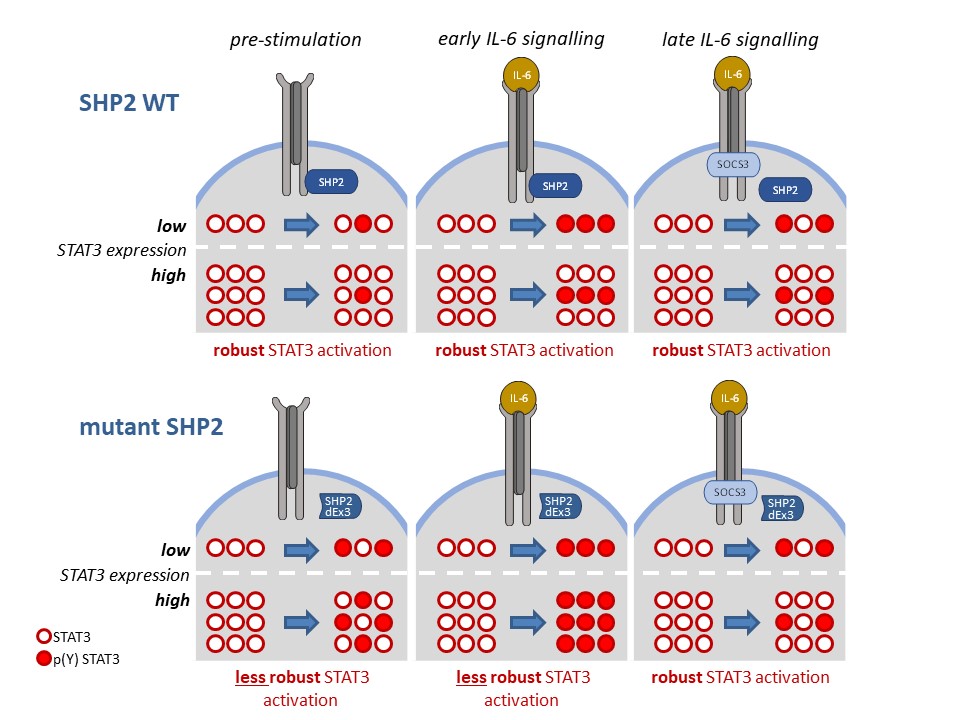
Zentrale Elemente der Signaltransduktionswege sind die Aktivierung bzw. Inaktivierung von Proteinen durch Veränderung ihres Phosphorylierungstatus, ihrer Konformation oder ihrer Lokalisation in der Zelle. Eine wichtige Funktion haben hierbei multi-site docking Proteine (z.B. Gab1), die eine Bindungsplattform für Signalmoleküle und regulatorische Proteine bieten. Weiterhin erfüllen regulatorische Proteine essentielle Aufgaben in der Signaltransduktion. Sie modulieren, beenden und integrieren Signalprozesse und tragen dazu bei, dass die Informationsweiterleitung robust ist. Zu den regulatorischen Proteinen gehören Phosphatasen (z.B. SHP2) und Kinaseinhibitoren (z.B. der feed-back Inhibitor SOCS3).